Eiskalt auf‘s Glatteis geführt
Produktübersicht: Transfektionssysteme
Alle Produkte im Überblick 
Auch in Zeiten automatisierter Labore und vernetzter Geräte besteht ein Großteil des Laboralltags noch immer aus Routinearbeiten. Zu diesen zählt auch die Transfektion eukaryotischer Zellen beziehungsweise die Transformation von Bakterien mit Nukleinsäuren.
In der Literatur tauchen immer wieder neue, teils sehr exotische Methoden für den Transfer von Nukleinsäuren in Zellen auf – und wenn man den Transfektionsbegriff etwas weiter fasst, auch von Proteinen und anderen Makromolekülen. Die meisten Biologen bleiben jedoch den altbewährten Techniken treu, die inzwischen bereits vierzig Jahre und mehr auf dem Buckel haben.
Ein Klassiker ist zum Beispiel die zu den chemischen beziehungsweise Reagenzien-basierten Transfektions-Methoden zählende Calcium-Phosphat-Präzipitation, die der niederländische Molekularbiologie Alex van der Eb gemeinsam mit seinem Postdoc Frank Graham bereits 1973 vorstellte.
Verblüffende Beobachtung
Bei ihren Versuchen, Bruchstücke von Adenoviren-DNA in Nierenzellen einzuschleusen, machten die beiden eine verblüffende Entdeckung: Mischten sie die Virus-DNA mit einer Calcium-Phosphat-Lösung und inkubierten den entstandenen feinen Calcium-Phosphat-DNA-Niederschlag mit den Nierenzellen, so integrierte sich die DNA in das Genom der Zellen, die hierauf Adenoviren produzierten. Den exakten Weg der winzigen Calcium-Phosphat-DNA-Partikel in die Zelle kennen Forscher auch 40 Jahre nach den Experimenten von Eb und Graham noch nicht genau. Den überwiegenden Teil der Partikel nehmen die Zellen aber offensichtlich durch Endocytose beziehungsweise Phagocytose auf.
Über die Jahre wurde die CalciumPhosphat-(CP)Transfektion optimiert und natürlich sind inzwischen auch entsprechende ‚Kits‘ erhältlich. Viel mehr als eine CaCl2-Lösung und einen Phosphat-Puffer enthalten diese in der Regel aber nicht. Und auch am Prinzip der CP-Transfektion hat sich seit Ebs und Grahams Pionierarbeit nichts grundlegendes geändert.
Leider ist auch ihr größter Schwachpunkt noch immer der gleiche: Nur leichte Veränderungen von pH-Wert, Temperatur oder Pufferkonzentration führen zu erheblichen Schwankungen der Transfektions-Effizienz. Da die Calcium-Phosphat-Präzipitation aber konkurrenzlos billig und einfach durchzuführen ist, nehmen Wissenschaftler dieses Manko gerne in kauf. Zumal die Methode sich auch an moderne Anwendungen adaptieren lässt. Modifiziert man die Calcium-Phosphat-Partikel zum Beispiel mit Polyethylenglycol, so sind sie auch als Lastesel für siRNA-Moleküle geeignet.
Ganz ähnlich wie die CP-Transfektion funktioniert auch die Transfektion mit Hilfe kationischer Lipide: Die aus einer kationischen Kopfgruppe sowie einer hydrophoben über einen Linker mit der Kopfgruppe verbundenen Domäne bestehenden Lipide bilden zusammen mit einem entsprechenden neutralen Co-Lipid positiv geladene Liposomen-Vesikel.
Lipide als Nukleinsäure-Träger
Die Nukleinsäuren binden an die Lipsomen, die zunächst an der Zellmembran adsorbieren und schließlich durch Endocytose von der Zelle einverleibt werden. Vermittelt durch das neutrale Co-Lipid fusionieren die Endosomen hierauf mit der Zellmembran und entlassen ihre DNA-Fracht ins Cytosol.
Die seit Ende der achtziger Jahre entwickelten kationischen Lipide basieren meist auf positiv geladenen Kopfgruppen aus tertiären oder quartären Aminen. Ein typischer Vertreter ist das auch heute noch sehr populäre Lipofectin. In vielen modernen Lipofektions-Reagenzien ersetzen jedoch kationische Polymere, wie zum Beispiel Polyethylenimin, die geladenen Lipide. Ihre Strukturen sind erstaunlich vielfältig und reichen von einfachen oder verzweigten Polyethyleniminen bis zu cyclischen Oligosacchariden oder baumartigen Dendrimeren.
Etliche Schwachpunkte
Die Transfektion mit kationischen Lipiden ist genauso simpel und günstig wie die CP-Transfektion, hat aber ebenfalls ein paar Schönheitsfehler. So sind zum Beispiel die Transfektionsraten in primären Zellen sowie in Suspensionskulturen aufgrund cytotoxischer Effekte ziemlich mies. Zudem beeinträchtigt das in vielen Zellkulturmedien enthaltene Serum den Transfer der Liposom-Nukleinsäure-Komplexe in die Zellen.
Ganz ohne chemische Hilfsmittel kommen physikalische Transfektions-Methoden aus, bei denen die Nukleinsäuren zum Beispiel mit einer Genkanone in die Zellen geschossen oder mit einer feinen Kapillare injiziert werden. Die am weitesten verbreitete physikalische Transfektions-Methode ist aber die Elektroporation, die Eberhard Neumann und Tai-Kin Wong 1982 am MPI für Biochemie in Martinsried erstmals für die Transfektion von Säugerzellen einsetzten.
Der Elektroporator der beiden bestand im wesentlichen aus einem Spannungsgenerator sowie einem Kondensator, der sehr kurze (5 µS) aber knackige Spannungspulse von 8 kV abfeuern konnte. Zwischen die Elektroden des Apparats platzierten die beiden eine Lösung, in der sich Tymidin-Kinase (TK)-defiziente Mausfibroblasten (LTK-) sowie ein Plasmid mit dem TK-Gen befanden. Nach drei Spannungsstößen bei 20 °C warteten Neumann und Wong einige Minuten. Anschließend strichen sie die Zellen auf TK-Selektionsplatten aus und stellten sie in den Inkubator. Und tatsächlich wuchsen die LTK- Zellen auf den Platten: Offensichtlich führten die Spannungsstöße zu kurzzeitigen Löchern in der Zellmembran, über die das TK-Plasmid in die Zelle gelangen konnte.
Einige Jahre später zeigte eine Gruppe der Firma Bio-Rad, dass die Elektro-Transformation mit einem kommerziellen Elektroporator auch bei E. Coli funktioniert und meldete hierauf ein Patent an. Das wäre nicht weiter erwähnenswert, hätte die Gruppe nicht ein kleines Detail des Elektroporations-Protokolls verändert, das Generationen von Forschern übernahmen, ohne groß darüber nachzudenken: Das Bio-Rad-Team lagerte die für die Elektroporation vorbereiteten Zellen auf Eis und kühlte auch die Elektroden während der Elektroporation.
Warum die Zellen kühlen?
Dieses Kühl-Prozedere, bei dem selbst die Reaktionsgefäße vorgekühlt werden, ist ziemlich umständlich und erschwert die eigentlich simpel durchzuführende Elektroporation beträchtlich.
Eine Gruppe um die Recombineering-Experten Francis Stewart, Rolf Müller sowie Youming Zhang von der Technischen Universität Dresden, dem Helmholtz-Institut für Pharmazeutische Forschung Saarland beziehungsweise der chinesischen Shandong Universität hatte offensichtlich keine Lust mehr auf die nervige Kühlerei. Zumal sie in der Literatur auch keinen vernünftigen Grund fand, der diese rechtfertigte.
Das deutsch-chinesische Team führte die Elektro-Transformationen von E. Coli-Zellen für ihre Recombineering-Experimente ganz einfach bei Raumtemperatur durch – und staunte nicht schlecht, dass diese nicht nur problemlos funktionierten, sondern auch zu deutlich höheren Transfektions- sowie Rekombinationsraten führten. Und zwar nicht nur in E. coli, sondern auch in etlichen anderen Gram-negativen oder -positiven Bakterien (Sci Rep, 6:24648, DOI: 10.1038/srep24648).
Raumtemperatur fördert Poren
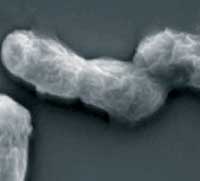
Die Gruppe untersuchte gekühlte und nicht-gekühlte Zellen unter dem Elektronenmikroskop und stellte fest, dass die gekühlten Zellen etwas zusammengeschrumpelt waren und die Oberfläche bei Raumtemperatur deutlich glatter wirkte. Die Forscher vermuten, dass dies auch Auswirkungen auf die Bildung von Poren in den Membranen und Wänden der Zellen hat – und diese bei Raumtemperatur leichter entstehen können.
Die im letzten Jahr publizierte Raumtemperatur-Elektroporation hat sich aber anscheinend noch nicht überall herumgesprochen. In so gut wie allen Anwendungsratgebern, Weiß-Papieren oder Protokollen, die man auf den Webseiten der einschlägigen Hersteller findet, ist noch von Bakterien-Zellen auf Eis sowie gekühlten Elektroporations-Küvetten die Rede.
Alle Produkte im Überblick 
(Erstveröffentlichung: H. Zähringer, Laborjournal 09/2017, Stand: September 2017, alle Angaben ohne Gewähr)
Letzte Änderungen: 14.09.2017