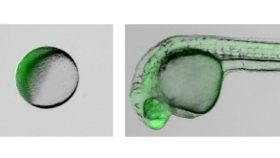
Klappt auch mit Fischen
(24.04.2024) Bisher favorisierten Forschende Mikroinjektion und Elektroporation. Viel einfacher funktioniert die Transfektion von Zebrafisch-Embryonen jedoch mit Lipofectamin.
Die Transfektion von Zebrabärbling-Embryonen erfordert Geduld und Fingerspitzengefühl. Die empfindsamen Zellen nehmen Eingriffe schnell übel und lassen Träume von einer effizienten Transfektion im Hochdurchsatz wie Seifenblasen zerplatzen. Forschende schleusen die transgene Fracht meist per Mikroinjektion mit einer hauchdünnen Nadel in die befruchteten Eizellen ein. Dabei ist jedoch Eile geboten, denn sobald sich die Zellen teilen, entstehen genotypische Mosaike. Die Elektroporation verwendet man vor allem für die Transformation während späterer Entwicklungsphasen, weil die Embryonen von Zebrabärblingen erst im Achtzell-Stadium robust genug sind, um den Elektroschock zu verkraften. Da nicht jede Zelle die transgene Fracht in gleichem Maß aufnimmt und hierdurch mosaike Individuen entstehen, eignet sich die Elektroporation vor allem für transiente Manipulationen.
Runzeliges Chorion
Viele Tier- und Pflanzenzellen (Protoplasten) lassen sich auch mit der Lipofektion transformieren, bei der DNA oder RNA in positiv geladene Liposomen verpackt und via Endozytose in die Zelle transportiert werden. Warum sollte die Lipofektion nicht auch bei Zebrabärblingen funktionieren, dachte sich Adrian Jacobos Gruppe, die am Chan Zuckerberg Biohub in San Francisco mithilfe von Zebrabärblingen die Morphogenese von Organen erforscht. Das Trio aus Kalifornien erstellte ein Protokoll für die Lipofektion von Zebrafisch-Embryonen mit mRNA sowie DNA, das sich für transiente oder stabile Genom-Manipulationen eignet (LINK unten).
Wie bei Mikroinjektionsnadel und Elektroporation muss die Fracht bei der Lipofektion durch die Membran der befruchteten Eizelle (Chorion) ins Innere der Zelle gelangen. Um dies zu bewerkstelligen, werden frisch gezüchtete befruchtete Eizellen zunächst mit Pronase (einem Mix aus Endo- und Exopeptidasen) behandelt, bis die Chorion runzelig erscheint. Anschließend wäscht man die Embryonen mehrmals mit einer Mineralienlösung für Zebrabärblinge (E3-Medium) und platziert sie in 30er-Gruppen auf Glasschalen.
mRNA mit Plus-Reagenz
Die Transfektionslösung wird in zwei Reaktionsgefäßen vorbereitet. Eines enthält 0,5 bis 2 Mikrogramm mRNA in einem 1:1-Gemisch (50 Mikroliter) aus einem Reagenz, das die Transfektionsrate erhöhen soll (Plus-Reagenz), sowie einem minimalen essentiellen Medium mit reduziertem fötalem Kälberserumgehalt (optiMEM). In das zweite Gefäß füllt man 3 Mikroliter Lipofectamin, das in optiMEM auf ein Gesamtvolumen von 50 Mikroliter verdünnt ist. Danach vereint man beide Ansätze und vermischt sie durch leichtes Schnipsen mit dem Finger an die Gefäßwand. Nach fünfminütiger Inkubation bei Raumtemperatur pipettiert man 400 Mikroliter E3-Medium hinzu und tropft die Mischung auf die vorbereiteten Embryonen. Die Transfektion findet bei 28 Grad Celsius statt und dauert ein bis vier Stunden. Anschließend werden die Embryonen in frisches E3-Medium überführt.
Die Kalifornier setzten für die Lipofektions-Versuche StayGold-mRNA ein, die eine besonders leuchtstarke und schnell reifende Variante des grün fluoreszierenden Proteins codiert. Für die Erzeugung stabil transformierter Zebrabärbling-Linien nutzten sie die Co-Transfektion von Tol2-Plasmid und Tol2-mRNA. Letztere sorgt für die Expression einer Transposase, die das auf dem Tol2-Plasmid bereitgestellte Transgen in das Genom einbaut. Die Transformation erfolgt wie oben beschrieben, mRNA und Plasmid werden jedoch vorab gemischt.
Keine Entwicklungsstörungen
Im Einzell-Stadium verzeichneten die Forschenden eine Transformationseffizienz von 95 Prozent. Während der fünftägigen Beobachtungszeit traten keinerlei Entwicklungsstörungen auf. Die Gruppe führte die Lipofektion mit Embryonen bis zum 16-Zell-Stadium durch, die Effizienz sank dabei von etwa 95 Prozent für das 2-Zell-Stadium auf 80, 40 sowie 15 Prozent für 4-, 8-, und 16-Zell-Stadien. Zudem entstanden in den späteren Entwicklungsstadien Mosaikorganismen.
Mit der Lipofektion kann man sowohl mRNA als auch DNA schnell und einfach in Zebrabärbling-Embryonen einschleusen und auch Co-Transfektionen durchführen. Jacobos Team geht davon aus, dass die Technik auch bei CRISPR-basierten Manipulationen funktioniert und sich auch für den Hochdurchsatz eignet.
Andrea Pitzschke
Terzi A. et al. (2024): Lipid-based transfection of zebrafish embryos: A robust protocol for nucleic acid delivery. BioRxiv, DOI: 10.1101/2024.04.11.589140.
Bild: Terzi et al.