Chemisches Editing
(18.10.17) In Krankenhäusern tauchen immer mehr Keime mit multiplen Antibiotika-Resistenzen auf, die schwer zu bekämpfen sind. Wer die molekularen Tricks einzelner Erreger kennt, weiß jedoch, wo er sie gezielt attackieren kann. Ein vielversprechendes Angriffsziel des Tuberkulose-Erregers Mycobacterium tuberculosis ist die Protein-Tyrosin-Phosphatase A.
Gelangen Keime in den Körper, werden sie normalerweise von Makrophagen verdaut, welche die Eindringlinge zusätzlich mit reaktiven Sauerstoffspezies bombardieren. Im ständigen koevolutionären Wettrüsten zwischen Pathogen und Wirt haben es resistente Tuberkulosekeime jedoch geschafft, in der oxidativen Umgebung von Makrophagen zu überleben, und dem proteolytischen Verdau zu entgehen. Hierzu sekretieren sie die Protein-Tyrosin-Phosphatase A (PtpA) als Virulenzfaktor ins Makrophageninnere, die das Endocytosesystem ihres Wirts außer Gefecht setzt und so das Ausreifen der Makrophagen verhindert.
PtpA enthält drei Cysteinreste im aktiven Zentrum beziehungsweise in der katalytischen Tasche, die eigentlich oxidationsanfällig sein sollten. Das oxidierte Protein verliert auch tatsächlich seine Aktivität. Wie es die Oxidation der Cys-Reste in Makrophagen dennoch verhindert, fand Goncalo Bernardes Gruppe von der Universität Lissabon heraus (Chem 3: 665-77).
Das Wissenschaftlerteam exprimierte das His-getaggte Protein zunächst in E.coli und reinigte es über Nickelsäulchen unter nativen Bedingungen. Danach ging es etwas unkonventioneller weiter: Die Gruppe führte durch chemisches Editing Mutationen in den Cys-Resten ein. Hierzu inkubierten die Forscher PtpA mit der Substanz α,α’-di-Brom-adipyl(bis)amid (chemischer Editor) welche die Cysteingruppen in Dehydroalanin (Dha) überführte.
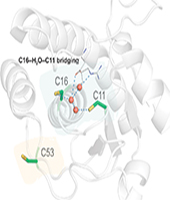
Die Reaktionen der einzelnen Cys-Reste hingen hierbei von der Konzentration des chemischen Editors sowie der Reaktionsdauer ab. Oxidationsanfällige Cysteingruppen verwandelten sich schneller in Dha als reaktionsträge. Bei niedrigen Konzentrationen des chemischen Editors von 1 bis 30 mM reagierte nur Cys53. Die beiden anderen Reste, Cys11 sowie Cys16 wandelten sich erst bei höherer Dosierung zu Dha um. Die Modifikation ist also äußerst regioselektiv.
Mit umfangreichen Strukturanalysen chemisch editierter PtpA-Varianten kam das Team von Bernardes dem Schutzmechanismus von PtpA gegen Oxidation auf die Spur. Cys53 ist demnach nicht am Katalyse-Mechanismus beteiligt und befindet sich auf der Proteinoberfläche, zu der sich nur hie und da ein Wassermolekül verirrt. Die Umwandlung von Cys53 zu Dha ändert wenig an der Struktur und beeinflusst die Proteinaktivität in keinster Weise. Cys53 opfert sich also, um die tatsächlich relevanten Cys11 sowie Cys16 im katalytischen Zentrum zu schützen.
Das ist jedoch nur eine Hälfte des vermutlichen Schutzmechanismus von PtpA gegen die Oxidation in Makrophagen. Die zweite ist das Zusammenspiel von Wassermolekülen mit Cys11 sowie Cys16. Beide Cystein-Reste sind weit weniger exponiert, in ihrer Umgebung herrscht ein hoher Solvatisierungsgrad. Cys11 liegt im katalytischen Zentrum, Cys16 an dessen Hintertürchen. Wassermoleküle schaffen zwischen den beiden Resten eine indirekte Verbindung, die ihr Zusammenspiel während der Katalyse moduliert und für die Aktivität essentiell ist. Das Wasser schmiegt sich so an das Protein, dass es dessen Faltung innerhalb der katalytischen Tasche vorgibt. Kovalente Bindungen sind dabei nicht im Spiel.
Gut möglich, dass dieses durch Wassermoleküle dirigierte Strukturelement unter bakteriellen PtpA-Proteinen weiter verbreitet ist. Auch in der Protein-Tyrosin-Phosphatase (SptpA) von Staphylococcus aureus, einem weiteren fiesen Krankheitserreger, fand die Gruppe eine ganz ähnliche Modulation der Cystein-Reste durch Wassermoleküle, die es offensichtlich vor der Oxidation schützt.
Nachdem diese Struktureigenheit von Protein-Tyrosin-Phosphatasen bekannt ist, können Forscher gezielt nach niedermolekularen Substanzen suchen, die das Zusammenspiel der Wassermoleküle mit den Cys-Resten stören.
Andrea Pitzschke
Letzte Änderungen: 10.11.2017